本文目录导读:
在化学领域,还原反应是一种重要的化学反应类型,SO2与H2SO3之间的还原反应是化学中常见且重要的反应之一,本文将详细探讨SO2还原H2SO3的原理、过程及其在化学工业中的应用。
SO2与H2SO3的基本性质
我们需要了解SO2和H2SO3的基本性质,二氧化硫(SO2)是一种无色、有刺激性气味的气体,具有还原性,而亚硫酸(H2SO3)是一种无色液体,具有弱酸性,其氧化性较弱,在一定的条件下,这两种物质之间可以发生还原反应。
SO2还原H2SO3的原理
SO2还原H2SO3的原理主要涉及到氧化还原反应,在反应过程中,SO2作为还原剂,将H2SO3中的S元素从+4价还原为+6价,生成硫酸(H2SO4),SO2中的S元素被氧化为+4价,生成亚硫酸根离子(SO3^2-),这一过程涉及到电子的转移和化合价的改变,是典型的氧化还原反应。
SO2还原H2SO3的过程
SO2还原H2SO3的过程通常需要一定的条件,如温度、压力和催化剂等,在常温常压下,这一反应通常较慢,但可以通过加热或使用催化剂来加速反应的进行,具体过程如下:
1、SO2与H2O反应生成亚硫酸(H2SO3)。

2、亚硫酸(H2SO3)在一定的条件下与氧气(O2)发生氧化反应,生成硫酸(H2SO4)。
3、在某些条件下,如存在其他还原剂或催化剂的作用下,部分亚硫酸(H2SO3)会与SO2发生还原反应,生成亚硫酸根离子(SO3^2-)和另一种物质(如硫单质等)。
应用领域
SO2还原H2SO3的反应在化学工业中具有广泛的应用,这一反应可以用于制备硫酸(H2SO4),因为硫酸是许多工业生产过程中必不可少的原料,通过控制反应条件,可以获得其他有用的化学物质,如硫单质等,这一反应还可以用于环境治理和废水处理等领域,如利用亚硫酸盐的还原性来去除废水中的重金属离子等污染物。
实验方法及步骤
为了验证SO2还原H2SO3的反应过程及原理,我们可以进行以下实验:
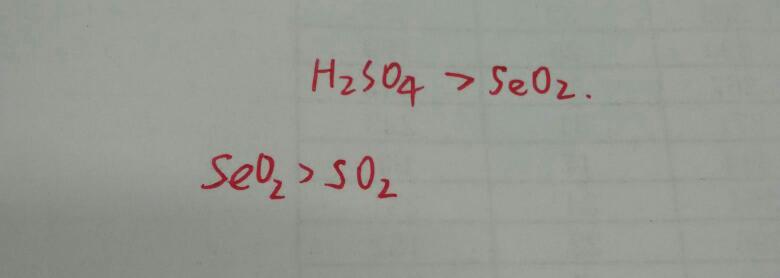
1、准备所需试剂和仪器:二氧化硫气体、亚硫酸溶液、蒸馏水、酸碱指示剂等试剂以及相应的实验仪器。
2、将一定量的二氧化硫气体通入亚硫酸溶液中,观察并记录实验现象。
3、加入适量的蒸馏水稀释溶液,并加入酸碱指示剂以观察溶液的酸碱变化。
4、继续通入二氧化硫气体并观察溶液的变化情况,若出现沉淀或颜色变化等明显现象,则说明发生了化学反应。
5、记录实验数据并分析结果,根据实验现象和结果分析SO2与H2SO3之间的还原反应过程及原理。
本文详细探讨了SO2与H2SO3之间的还原反应原理及过程,通过了解这两种物质的基本性质和氧化还原反应的原理,我们可以更好地理解这一反应的实质,这一反应在化学工业中具有广泛的应用价值,如制备硫酸、环境治理和废水处理等领域,通过实验验证了这一反应的过程及原理,为进一步研究和应用提供了理论依据和实践经验。
本文对SO2与H2SO3之间的还原反应进行了全面的分析和探讨,希望对读者了解这一反应的原理和过程有所帮助,同时也为化学工业的发展和应用提供一定的参考价值。
版权声明
本文仅代表作者观点,不代表百度立场。
本文系作者授权百度百家发表,未经许可,不得转载。